测试中心相容性,密封性研究团队自成立以来,致力于提供高质量定制化的药品相容性,密封性研究服务,在相容性研究领域,团队一直遵循PQRI建议的研究流程(表征、模拟、浸出),每个品种均基于质量源于设计(QbD)的理念,在熟知产品工艺特点下选择经过充分表征的材质,为产品确定适合的包装系统、生产组件及匹配的给药装置,各项研究结论均提供风险评估报告。研究结果能够满足境内外多体系药物注册申报研究要求,支持客户审计,并可以配合完成全球各或地区药监部门的现场核查。
1.药包材相容性研究:
定义:是指为了证明包装材料与药品之间没有发生严重的相互作用,并导致药品有效性和稳定性发生改变,或者产生安全性风险的过程,包括包装材料对药品的影响,以及药品对包装材料的影响。
产品涵盖:西林瓶,胶塞,安瓿瓶,预灌封,塑料瓶,口服瓶,卡式瓶,滴眼液瓶,气雾瓶等
2.生产系统相容性研究:
定义:主要考察生产系统也药物之间是否发生浸出、迁移或吸附的现象,进而影响药物质量和安全而进行的系列研究过程。
产品涵盖:硅胶管,滤芯,不锈钢组件,配液罐,垫圈,超滤膜包,视窗玻璃,泵体等
3.一次性输液系统相容性研究:
定义:主要考察输液系统与药物之间是否发生相互作用的研究过程。
产品涵盖:一次性输液器,一次性注射器,雾化系统等
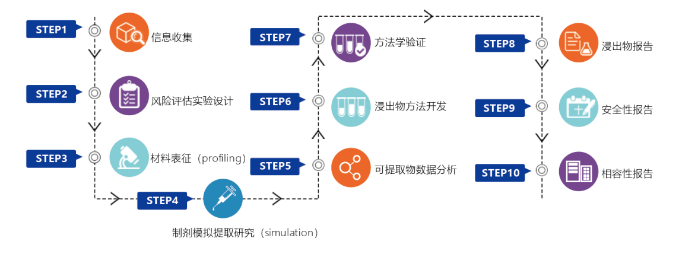
研究流程
我们的仪器

相容性研究相关法规
美国药典(U.S.Pharmacopeia,USP)<381>、<660>、<1660>、<661>、<1661>、<1663>、<1664>
《化学药品注射剂与塑料包装材料相容性研究技术指导原则(试行)》(2012)
《化学药品注射剂与药用玻璃包装容器相容性研究技术指导原则(试行)》(2015)
《化学药品与弹性体密封件相容性研究技术指导原则(试行)》(2018)
《中国药典》2020版等
ICHQ3D
PQRI
在密封性研究方面,容器密封完整性是容器对其内容物提供防护和保护的能力。确保注射剂的容器密封完整性对于注射剂的整个生命周期(包括生产、存储、运输、使用等环节)是非常重要的。注射剂的容器密封完整性除了能够提供一般容器的基本保护功能外,还能防止微生物的污染,从而确保注射剂的无菌安全性能。同时,对于一些对氧气、湿气敏感的药品,容器密封完整性还能使药品免受氧气和湿气的影响。注射剂容器密封完整性已成为药品稳定性研究的重要组成部分。
容器密封完整性测试(ContainerClosureIntegrityTest,CCIT)是测试一个包装是否密封到特定水平的方法。苏研院分析测试中心参考《化学药品注射剂包装系统密封性研究技术指南(试行)》、USP<1207>等相关技术要求开展包装系统密封完整性的研究验证,密封性检测优选能检测出产品允许泄漏限度的确定性方法,如方法灵敏度无法达到产品允许泄漏限度水平,建议至少采用两种方法(其中一种推荐微生物挑战法)进行密封性验证。
由于密封性测试没有单一测漏方法能普适所有需求,苏研院分析测试中心拥有多年的容器密封完整性测试的经验,可为客户的产品剂型及其包装的特点,合理选择检测方法并制定研究方案,能符合中国、美国、欧洲申报使用。
我们提供的服务
1、各种类型包材的密封性研究
Ø无菌注射剂:西林瓶胶塞、安瓿瓶、预充针(预灌封注射器)、卡式瓶、软袋、输液瓶、塑料瓶
Ø无菌原辅料:塑料袋、原液冻存袋
Ø滴眼液
2、线上全检方法的验证及转移
Ø正负压法
Ø色水法
3、色水侵入试验(概率性方法)
Ø方法开发优化(选择合适压力/真空度、温度、染料、表面张力去除试剂等条件)
Ø可优于微生物侵入
Ø半定量(分光光度计)
Ø目视法判定
Ø二项式统计(系列孔径至少60个阳性瓶的研究)
4、微生物侵入挑战(概率性方法)
Ø方法学验证(选择合适压力/真空度、温度、菌株等条件)
Ø二项式统计(系列孔径至少60个阳性瓶的研究)
Ø同商业化生产拟采用的第二法的灵敏度比较
5、真空衰减法(确定性方法)
ØLOD可达1μm
Ø定量验证检测而非P/F定性验证检测
Ø适用范围广
我们的仪器

中国科学院上海药物所苏州药物创新研究院所属平台以的设施设备为基础,中心目前已经具备了承担参比制剂逆向剖析、微量杂质分析、药品包材相容性研究、基因毒性杂质研究、药学质量研究等检测分析及研究开发的技术平台。
中心有药学研究、分析检测、体系认证领域专家及教授作为专业技术指导,为中心重点研究项目提供决策依据及技术难题的攻关指导;其他项目经理,技术骨干负责日常实验的执行、数据报告的核对。一线实验技术人员均为本科以上学历,熟悉各项检测方法、程序。的专家导师与勤奋刻苦的项目经理组成了中心的中坚力量,加之研究院决策层熟悉整个工作流程,对相关合规及技术要求有深入的理解,从而保证了承接的各个项目均能完善彻底的执行,保质保量的完成。
参照标准:NMPA FDA ICH BPQG WHO
风险评估、药包材筛选、提取试验,模拟实验、迁移实验、 进行加速、长期稳定性样品测试, 迁移物/浸出物进行安全性评估,确定其安全性

